세륨 희토류 원소군에서 단연 '큰형'입니다. 첫째, 지각 내 희토류 원소의 총 존재비는 238ppm이며, 세륨은 68ppm으로 전체 희토류 원소의 28%를 차지하며 1위를 차지합니다. 둘째, 세륨은 이트륨(1794년)이 발견된 지 9년 만에 발견된 두 번째 희토류 원소입니다. 그 응용 분야는 매우 광범위하며, "세륨"은 막을 수 없습니다.
세륨은 1803년 독일 클로퍼스, 스웨덴 화학자 요네즈 야콥 베르셀리우스, 그리고 스웨덴 광물학자 빌헬름 히싱거에 의해 발견되어 명명되었습니다. 세륨은 세리아(ceria)라고 불리며, 그 광석은 1801년에 발견된 소행성 세레스(Ceres)를 기리기 위해 세라이트(cerite)라고 불립니다. 실제로 이 유형의 세륨 규산염은 66~70%의 세륨을 함유한 수화염이며, 나머지는 칼슘, 철,이트륨.
세륨은 오스트리아 화학자 카를 아우어 폰 벨스바흐가 발명한 가스 난로에서 처음 사용되었습니다. 1885년, 그는 마그네슘, 란탄, 산화 이트륨의 혼합물을 시도했지만, 이 혼합물들은 녹색 빛을 냈을 뿐 성공하지 못했습니다.
1891년, 그는 순수한 산화토륨이 푸른색이기는 하지만 더 나은 빛을 낸다는 것을 발견했고, 산화세륨(IV)과 혼합하면 밝은 흰색 빛을 낼 수 있다는 것을 발견했습니다. 또한, 산화세륨(IV)은 산화토륨 연소 촉매로도 사용될 수 있습니다.
세륨 금속

★ 세륨은 연성이 있고 부드러운 은백색 금속으로 활성이 있습니다. 공기에 노출되면 산화되어 녹처럼 벗겨지는 산화막을 형성합니다. 가열하면 연소되어 물과 빠르게 반응합니다. 1cm 크기의 세륨 금속 샘플은 약 1년 이내에 완전히 부식됩니다. 공기, 강산화제, 강산, 할로겐과의 접촉을 피하십시오.
★ 세륨은 주로 모나자이트와 바스트네사이트에 존재하며, 우라늄, 토륨, 플루토늄의 핵분열 생성물에도 존재합니다. 환경에 유해하므로 수역 오염에 특히 주의해야 합니다.
★ 세륨은 지구 지각에서 26번째로 풍부한 원소로, 68ppm을 차지하며 구리(68ppm)에 이어 두 번째로 풍부합니다. 세륨은 납(13ppm)과 주석(2.1ppm)과 같은 일반 금속보다 풍부합니다.
세륨 전자 배열
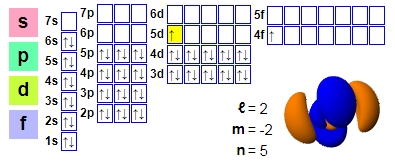
전자적 준비:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f1 5d1
★ 세륨은 란탄 뒤에 위치하며, 세륨에서 시작하는 4f 전자를 가지고 있어 화학 반응에 쉽게 참여할 수 있습니다. 그러나 세륨의 5d 오비탈은 이미 점유되어 있어 이 효과가 세륨에서는 충분히 강하지 않습니다.
★ 대부분의 란타넘족 원소는 전자 구조가 가변적인 세륨을 제외하고 원자가 전자로 세 개의 전자만 사용할 수 있습니다. 4f 전자의 에너지는 금속 상태에서 비국재화된 외부 5d 및 6s 전자의 에너지와 거의 같으며, 이러한 전자 에너지 준위의 상대적인 점유를 변화시키는 데 필요한 에너지는 매우 적어 +3과 +4의 이중 원자가를 형성합니다. 정상적인 상태는 +3 원자가이며, 혐기성 수에서는 +4 원자가를 보입니다.
세륨의 응용

★ 합금첨가제 및 세륨염 등의 생산에 활용 가능
★ 자외선과 적외선을 흡수하는 유리첨가제로 사용 가능하며, 자동차 유리에 널리 사용됩니다.
★ 우수한 환경보호 소재로 활용 가능하며, 현재 가장 대표적인 것은 자동차 배기가스 정화 촉매로, 대량의 자동차 배기가스가 대기 중으로 배출되는 것을 효과적으로 방지합니다.
★ 빛희토류 원소주로 세륨으로 구성된 식물 생장 조절제는 작물 품질을 개선하고, 수확량을 늘리고, 작물 스트레스 저항성을 강화하는 데 도움이 됩니다.
★ 황화세륨은 안료에서 환경과 인간에게 유해한 납, 카드뮴과 같은 금속을 대체할 수 있으며, 플라스틱을 착색할 수 있고, 코팅 및 잉크 산업에도 사용할 수 있습니다.
★세륨(IV) 산화물예를 들어 화학-기계 연마(CMP)에서 연마제로 사용될 수 있습니다.
★ 세륨은 수소 저장 소재, 열전 소재, 세륨 텅스텐 전극, 세라믹 커패시터, 압전 세라믹, 세륨 탄화규소 연마재, 연료 전지 원료, 가솔린 촉매, 영구자석 소재, 의료용 소재, 각종 합금강 및 비철 금속으로도 활용 가능합니다.
게시 시간: 2023년 7월 3일
