루테튬는 가격이 높고 매장량이 적으며 용도가 제한적인 희귀 희토류 원소입니다. 연성이고 묽은 산에 용해되며 물과는 천천히 반응합니다.
자연적으로 발생하는 동위 원소로는 175Lu와 2.1 × 10^10년의 반감기를 가진 β-방출체 176Lu가 있습니다. 이는 플루오린화루테튬(III) LuF∨·2H₂O를 칼슘으로 환원시켜 얻습니다.
주요 사용은 석유 분해, 알킬화, 수소화 및 중합 반응의 촉매로 사용됩니다. 또한, 탄탈루테튬은 X선 형광 분말의 재료로도 사용될 수 있습니다. 방사성 핵종인 177Lu는 종양의 방사선 치료에 사용될 수 있습니다.

역사의 발견
발견자: G. Urban
1907년에 발견됨
루테튬은 1907년 프랑스 화학자 울반(Ulban)에 의해 이테르븀(Ytterbium)에서 분리되었으며, 20세기 초에 발견되어 확인된 희토류 원소이기도 합니다. 루테튬의 라틴어 이름은 우르반(Urban)의 고향인 프랑스 파리의 옛 이름에서 유래했습니다. 루테튬과 또 다른 희토류 원소인 유로퓸(Europium)의 발견으로 자연에 존재하는 모든 희토류 원소의 발견이 완료되었습니다. 이 발견은 희토류 원소 발견의 네 번째 관문을 열고 희토류 원소 발견의 네 번째 단계를 완료한 것으로 볼 수 있습니다.
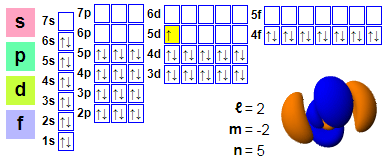
전자 배열
전자적 준비:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1
루테튬은 희토류 원소 중 가장 단단하고 밀도가 높은 은백색 금속입니다. 녹는점은 1663℃, 끓는점은 3395℃이며, 밀도는 9.8404입니다. 루테튬은 공기 중에서 비교적 안정합니다. 산화루테튬은 무색 결정으로, 산에 용해되어 무색의 염을 형성합니다.
루테튬의 희토류 금속 광택은 은과 철의 중간 정도입니다. 불순물 함량은 루테튬의 특성에 상당한 영향을 미치기 때문에 문헌에서 물리적 특성에 상당한 차이가 있는 경우가 많습니다.
이트륨, 가돌리늄, 루테튬 등의 금속은 내식성이 강하여 장기간 금속광택을 유지할 수 있다.
애플리케이션
생산의 어려움과 높은 가격 때문에 루테튬은 상업적으로 거의 사용되지 않습니다. 루테튬의 특성은 다른 란타넘족 금속과 크게 다르지 않지만, 매장량이 상대적으로 적기 때문에 많은 곳에서 루테튬을 대체하기 위해 다른 란타넘족 금속이 사용됩니다.
루테튬은 중성자 활성화 분석에 사용되는 루테튬 알루미늄 합금과 같은 특수 합금을 만드는 데 사용될 수 있습니다. 또한 루테튬은 석유 분해, 알킬화, 수소화 및 중합 반응의 촉매로도 사용될 수 있습니다. 또한, 이트륨 알루미늄 가넷과 같은 일부 레이저 결정에 루테튬을 도핑하면 레이저 성능과 광학 균일성을 향상시킬 수 있습니다. 또한, 루테튬은 형광체에도 사용될 수 있습니다. 루테튬 탄탈레이트는 현재 알려진 가장 조밀한 백색 물질이며, X선 형광체에 이상적인 재료입니다.
177Lu는 종양의 방사선 치료에 사용될 수 있는 합성 방사성 핵종입니다.
산화루테튬도핑된 세륨 이트륨 루테튬 규산염 결정
게시 시간: 2023년 6월 26일